Wenn Blutgefäße zu durchlässig sind
Blutgefäße bieten neue Ansatzpunkte für die Behandlung chronisch-entzündlicher Darmerkrankungen
In Deutschland leiden etwa 400.000 Menschen an chronisch-entzündlichen Darmerkrankungen. Am Universitätsklinikum Erlangen gelang jetzt erstmals der Nachweis, dass Fehlsteuerungen in Blutgefäßen eine wesentliche Rolle bei der Entstehung solcher Krankheiten spielen. Durch die Behebung dieser Fehlsteuerung konnte in experimentellen Modellsystemen der Krankheitsverlauf deutlich verbessert werden. Ihre Ergebnisse veröffentlichten die Erlanger Forscherinnen und Forscher jetzt im Journal of Clinical Investigation.
Erkrankungen des Menschen basieren häufig auf fehlgesteuerten Zellen. Bei Untersuchungen zu den Mechanismen chronisch-entzündlicher Darmerkrankungen standen bisher die Epithelzellen, die die Barriere vom Darm zum umgebenden Gewebe aufbauen, und die Entzündungszellen im Vordergrund. Obwohl bekannt ist, dass Entzündungszellen nur über die Blutgefäße in die entsprechenden Gewebe gelangen können, wurde die Rolle von Blutgefäßen bei chronisch-entzündlichen Darmerkrankungen bisher nur am Rande erforscht. Eine vertiefende Untersuchung zur Rolle von Blutgefäßen hat jetzt eine Forschergruppe der Molekularen und Experimentellen Chirurgie (Leiter: Prof. Dr. Michael Stürzl) an der Chirurgischen Klinik (Direktor: Prof. Dr. Robert Grützmann) in Zusammenarbeit mit Gruppen der Medizinischen Klinik 1 – Gastroenterologie, Pneumologie und Endokrinologie (Direktor: Prof. Dr. Markus F. Neurath) des Uni-Klinikums Erlangen und des Optical Imaging Centre Erlangen (OICE) der Friedrich-Alexander-Universität Erlangen-Nürnberg durchgeführt.
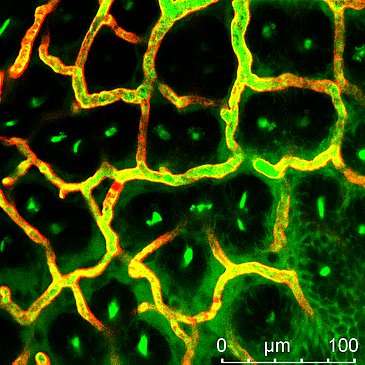
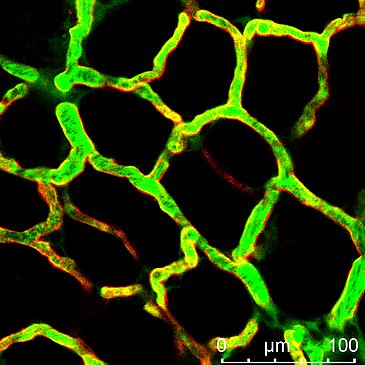
Stark durchlässige Blutgefäße
Das interdisziplinäre Kooperationsprojekt, das im Wesentlichen Victoria Langer im Rahmen ihrer Doktorarbeit experimentell umsetzte, ergab, dass die Blutgefäße bei chronisch-entzündlichen Darmerkrankungen besonders durchlässig (permeabel) sind. Als Ursache identifizierten die Forscherinnen und Forscher in molekularen Analysen eine fehlgesteuerte Zell-Zell-Interaktion bei den Endothelzellen. Endothelzellen bilden die Hülle von Blutgefäßen und sind für deren Dichtigkeit verantwortlich. Die Fehlsteuerung wird durch ein spezifisches Zytokin verursacht, das als Interferon-γ bezeichnet wird und das im chronisch entzündeten Darmgewebe in erhöhten Konzentrationen vorliegt. Die erhöhte Permeabilität der Blutgefäße konnte an verschiedenen experimentellen Modellen und auch bei Patientinnen und Patienten mit chronisch-entzündlichen Darmerkrankungen nachgewiesen werden.
Die große Bedeutung der Blutgefäßpermeabilität zeigte sich, als mit genetischen Verfahren am experimentellen Tiermodell die Fähigkeit von Endothelzellen, auf Interferon-γ zu reagieren, gehemmt wurde und dies den Krankheitsverlauf deutlich abschwächte. Von besonderer klinischer Bedeutung ist, dass auch das Medikament Imatinib (Glivec®) die Gefäßdurchlässigkeit hemmte, was den Krankheitsverlauf ebenfalls deutlich unterdrückte. Imatinib (Glivec®) wird bisher vorwiegend in der Krebstherapie eingesetzt.
Die Studie der Erlanger Wissenschaftlerinnen und Wissenschaftler belegt erstmals die große Bedeutung des Blutgefäßsystems bei chronisch-entzündlichen Darmerkrankungen und eröffnet neue Ansätze für die Therapie. Prof. Stürzl nahm chronisch-entzündliche Darmerkrankungen erst vor wenigen Jahren in sein Forschungsspektrum auf. Er hebt besonders die hervorragenden Kompetenzen rund um Entzündungsprozesse und optische bildgebende Verfahren hervor, die das Uni-Klinikum Erlangen und die FAU Erlangen-Nürnberg bieten und die ihm einen raschen und erfolgreichen Quereinstieg ermöglichten. Nun hat Michael Stürzl die neu erkannten Krankheitsmechanismen und neue Behandlungsmöglichkeiten im Blick. Er sagt: „Wir hoffen natürlich sehr, dass unsere Ergebnisse langfristig den Patientinnen und Patienten mit chronisch-entzündlichen Darmerkrankungen nützen. Dies wird nicht zuletzt dadurch unterstützt, dass das Medikament, das im Tiermodell erfolgreich war, auch schon für klinische Anwendungen zugelassen ist.“
Weitere Informationen:
Prof. Dr. Michael Stürzl
Telefon: 09131 85-39522
E-Mail: michael.stuerzl(at)uk-erlangen.de